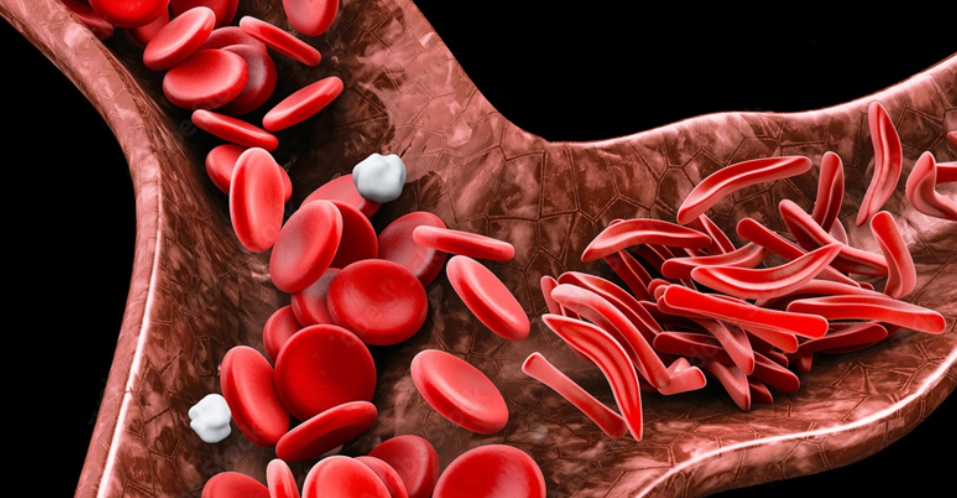
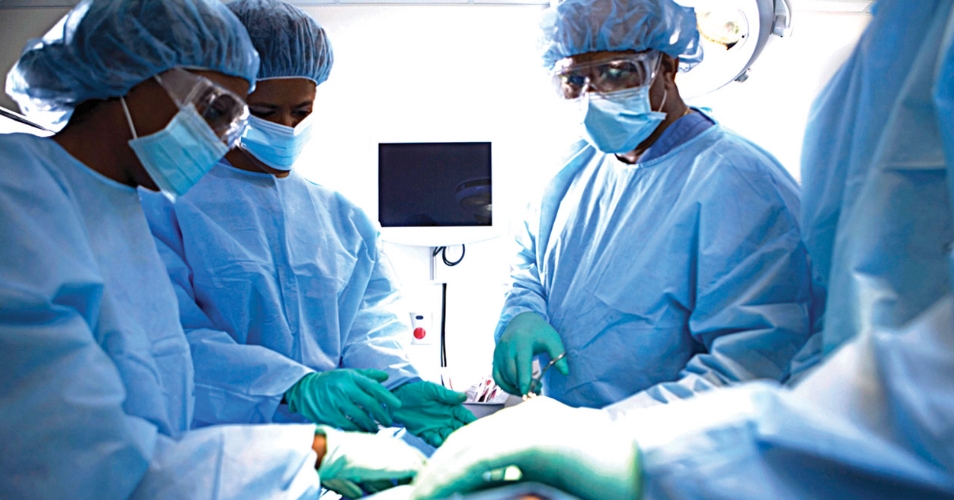
美国-based 医生已经敦促联邦政府加强立法,使每个孩子在出生时都必须进行镰状细胞疾病筛查。他们在全球镰刀细胞病联盟(GANSID) clinician mentorship项目期间做出了这个决定,这个项目的主题是“镰刀细胞病中坚强生活——知识、力量和希望”,地点在奥约州伊巴丹。这个项目是由全球镰刀细胞病及其他遗传性血液疾病行动网络与Chrisbo HB Champions Club联合组织的。在活动上,宾夕法尼亚州儿童医院GANSID的拉萨克·奥拉奥塞比坎博士指出,尼日利...
-
2025.09.04 | zbk7655 | 471次围观
-
2025.10.05 | zbk7655 | 365次围观
-
2025.09.04 | zbk7655 | 520次围观
-
2025.10.09 | zbk7655 | 328次围观
-
2025.11.17 | zbk7655 | 437次围观
-
2025.09.25 | zbk7655 | 458次围观
-
2025.09.09 | zbk7655 | 432次围观
-
2025.09.09 | zbk7655 | 430次围观
-
2025.09.09 | zbk7655 | 463次围观
-
2025.09.09 | zbk7655 | 436次围观
-
2025.09.09 | zbk7655 | 427次围观
-
2025.09.09 | zbk7655 | 441次围观
-
2025.09.09 | zbk7655 | 420次围观
-
2025.09.09 | zbk7655 | 444次围观